Vue d’ensemble La lutte contre le cancer s’est longtemps concentrée sur la destruction directe des cellules tumorales. Cependant, l’écosystème dans lequel vit une tumeur — le microenvironnement tumoral (MET) — joue un rôle tout aussi critique dans la progression de la maladie et la résistance aux traitements. Une étude importante menée par des chercheurs de l’Institut Courtois d’innovation biomédicale (CI2B) et du Département de pharmacologie et physiologie de l’Université de Montréal a identifié une nouvelle cible moléculaire qui non seulement freine la croissance tumorale, mais diminue et reprogramme également les vaisseaux sanguins de la tumeur pour inviter une puissante attaque immunitaire. Les résultats, publiés dans Cell Reports, se concentrent sur une protéine appelée PAK2 et une chimiokine connue sous le nom de CXCL10, offrant une nouvelle voie prometteuse pour améliorer l’immunothérapie.
Le problème vasculaire dans le cancer Pour se développer, les tumeurs solides nécessitent la formation de nouveaux vaisseaux sanguins au sein du MET, un processus appelé angiogenèse. Cependant, contrairement aux vaisseaux sanguins sains, les vaisseaux tumoraux sont chaotiques, perméables et désorganisés. Cette immaturité structurelle entraîne une mauvaise circulation sanguine et crée un environnement hostile dans lequel les tumeurs prospèrent, qui exclut souvent les « soldats » du système immunitaire, tels que les lymphocytes T, les cellules dendritiques et les cellules Natural Killer (NK), protégeant ainsi la tumeur des défenses naturelles de l’organisme.
Des thérapies visant à détruire les vaisseaux sanguins tumoraux et à les normaliser — en les rendant plus structurés et moins perméables — afin de réduire la croissance tumorale sont disponibles, mais des limites restreignent l’efficacité. L’équipe de recherche, dirigée par le Dr Jean-Philippe Gratton, a étudié le rôle de la p21-activated kinase 2 (PAK2), une protéine fortement exprimée dans les cellules endothéliales, qui tapissent l’ensemble des vaisseaux sanguins et initient l’angiogenèse.
Un double mécanisme : Supprimer l’angiogenèse et améliorer la réponse immunitaire En supprimant le gène PAK2 spécifiquement dans les cellules endothéliales de souris porteuses de tumeurs, les chercheurs ont observé une réduction marquée de la taille des tumeurs et de l’angiogenèse. Au-delà de la simple réduction du nombre de vaisseaux, l’absence de PAK2 a « normalisé » la vascularisation restante. Les vaisseaux sanguins sont devenus plus stables, avec une meilleure couverture par les péricytes (cellules qui soutiennent les parois des vaisseaux) et une perméabilité significativement réduite. Cette normalisation vasculaire est une étape critique pour transformer une tumeur « froide », qui exclue le système immunitaire, en une tumeur « chaude », susceptible d’être attaquée.
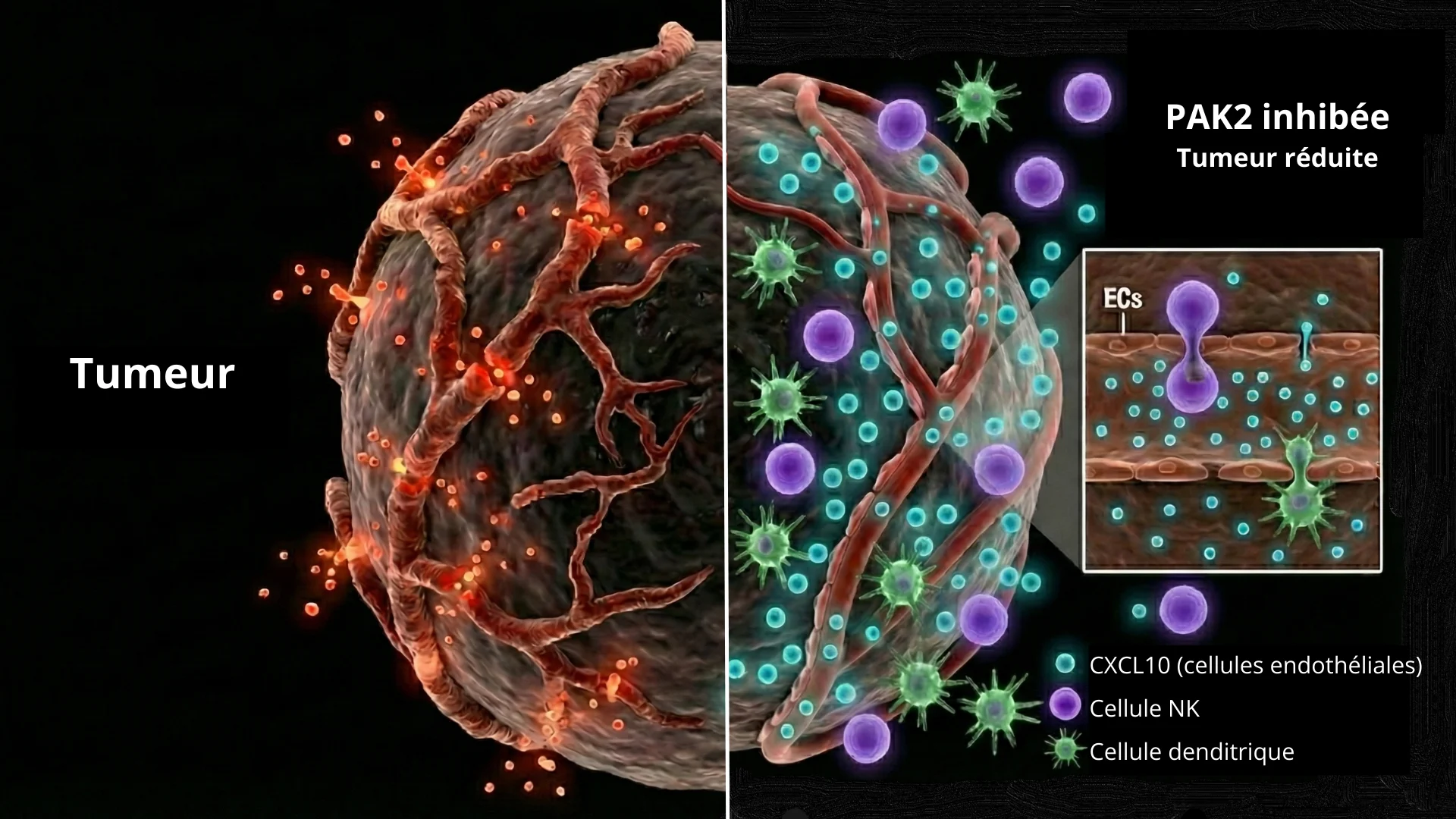
La découverte la plus frappante de l’étude est que la perte de PAK2 dans les cellules endothéliales a déclenché une réponse immunitaire innée robuste. Les tumeurs déficientes en PAK2 endothéliale ont montré une augmentation significative de l’infiltration de cellules dendritiques et de cellules NK, qui sont cruciales pour reconnaître et tuer les cellules cancéreuses.
La connexion immunitaire : L’axe CXCL10 Pour comprendre comment la suppression d’une kinase dans les parois des vaisseaux sanguins pouvait appeler les cellules immunitaires, l’équipe a analysé les changements génétiques au sein de la tumeur. Ils ont découvert que PAK2 agit comme un régulateur qui supprime la production de chimiokines — des protéines de signalisation qui attirent les cellules immunitaires. Plus précisément, la suppression de PAK2 a conduit à une augmentation de l’expression de CXCL10, un puissant chimio attractif.
Les chercheurs ont démontré que CXCL10 est le moteur clé de ces effets bénéfiques. Lorsqu’ils ont bloqué CXCL10 à l’aide d’anticorps neutralisants, les bienfaits anti-tumoraux de la suppression de PAK2 ont été inversés : les vaisseaux sont redevenus nombreux et chaotiques, et les cellules immunitaires n’ont pas réussi à infiltrer la tumeur.
Implications pour l’immunothérapie Cette étude met en évidence la PAK2 endothéliale comme une cible thérapeutique potentielle. En inhibant cette protéine, il pourrait être possible de réduire et reprogrammer la vascularisation tumorale non seulement pour priver la tumeur de ressources, mais aussi pour recruter activement le système immunitaire sur le site de la maladie.
« Nos résultats identifient la protéine endothéliale PAK2 comme une cible potentielle pour limiter l’angiogenèse tumorale et reprogrammer les cellules endothéliales afin de favoriser l’infiltration immunitaire via la signalisation CXCL10 », concluent les auteurs. Cette approche pourrait être particulièrement précieuse pour améliorer l’efficacité des immunothérapies existantes, qui échouent souvent parce que les cellules immunitaires ne peuvent pas pénétrer efficacement le cœur de la tumeur.
Collaborations Cette étude a été menée en collaboration avec des chercheurs de l’Institut de recherches cliniques de Montréal (IRCM) et de l’Institut de recherche en immunologie et en cancérologie (IRIC).



